田克恭:建议转基因生物安全评价与新兽药注册申报并行开展
- 点击:
- 日期:2019-03-08 15:39
- 来源:未知
澎湃新闻获悉,今年全国两会期间,来自河南的全国人大代表、国家兽用药品工程技术研究中心主任田克恭,向大会提交了《关于加快动物基因工程疫苗评审,实行转基因生物安全评价与新兽药注册申报并行开展的建议》(下称“建议”)。
田克恭认为,一个基因工程疫苗产品从开始申请转基因生物安全评价到获得新兽药证书至少需要7至10年,周期过长,该举措可实现在生产性试验过程中同时收集相关数据,从而缩短新兽药注册申报周期。
田克恭在建议中介绍,对于通过基因工程技术获得的基因工程疫苗产品,按照原农业部公告第442号《兽用生物制品注册分类及注册资料要求》的规定,新兽药注册资料中必须提供基因工程产品的安全审批书,即新兽药申报临床试验前必须申报并获得转基因生物安全证书。
转基因生物安全评价在实验室研究结束后,共需要进行4个阶段的申报:中间试验、环境释放、生产性试验、安全证书。每个阶段至少需要1年的时间,即获得转基因生物安全证书至少需要4至5年;而新兽药从申报临床到获得注册证书至少也需要3至5年。一个基因工程疫苗产品从开始申请转基因生物安全评价到获得新兽药证书至少需要7至10年,周期太长。
田克恭在建议中指出,转基因生物安全申报与新兽药临床申报有相同之处,包括均需要开展实验室研究,包括动物用转基因微生物的构建(生产用菌毒种的研究)及实验室制品的安全性评价;实验室阶段评价完成后,均需要在临床开展动物试验评价;同时,均需要评价动物用转基因微生物对临床靶动物的安全性。
但两者申报的不同之处在于,动物用转基因生物安全申报除了涉及对动物的安全性外,还包括对人类的安全性、对生态环境的安全性,动物用转基因微生物在环境中释放的范围、稳定性、竞争性、生存能力等;而新兽药申报除了涉及制品的安全性外,还需要考虑制品的有效性及质量控制水平。
此外,动物用转基因生物安全申报和新兽药申报过程均需要在临床开展动物试验评价,两者主要差异在于不同阶段试验动物数量、试验过程中的检测项目等。试验过程不同的检测项目可在试验过程中根据申报的要求分别实施。
(1)动物用转基因生物安全评价各阶段要求的靶动物数量(见《农业转基因生物安全评价管理办法》附录)
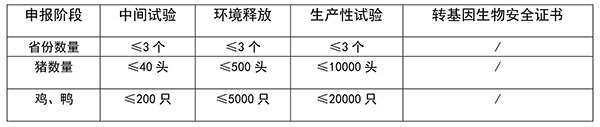
(2)新兽药临床试验要求的靶动物数量(见原农业部公告第2326号)

转基因生物安全评价阶段整体时间过长,对于重大突发动物疫病的防控难以及时发挥作用,而新兽药临床试验前的研究和动物用转基因生物安全评价生产性试验前研究均可确保各自研究对象的使用安全性不会出现较大的偏差。
因此,田克恭建议,动物用转基因生物安全评价与新兽药注册申报并行开展。新兽药临床试验申请与转基因生物安全评价的生产性试验(即第三阶段)同时进行,试验过程同时收集相关数据,缩短新兽药注册申报周期。
申报新兽药临床试验时,只需提供农业农村部批准的允许开展生产性试验的审批书,而不是必须获得转基因生物安全证书。但批准获得新兽药证书前,必须已获得该产品的转基因生物安全证书。
- 2020-02-14圆环病毒病和副猪嗜血杆菌病混合感染怎么办?普莱柯再出可作联免
- 2018-01-31田克恭当选第十三届全国人大代表
- 2017-03-314.13相约洛阳!普莱柯生物新工艺圆健上市发布会
| 查看所有评论 最新评论 | |
|
|
|
| 发表评论 | |||
|













