当“上帝的手术刀”划破猪的基因密码,能否掀起生猪养殖业革命?
- 点击:
- 日期:2020-09-29 08:50
- 来源:前瞻经济学人
近年来,被誉为“上帝的手术刀”——基因编辑获得了前所未有的关注与创新机会。借助这一技术,我们看到了它在生物改造方面的诸多潜力。
说到基因编辑,中国最大的努力是在农业领域,但研究人员也在将编辑器大规模应用于动物,最近频频登上头条的基因编辑猪是一大典型例子。
近日,中国农科院北京畜牧兽医研究所基因工程与种质创新团队联合华中农业大学、加拿大圭尔夫大学等,通过基因编辑技术获得全球首例抗三种重大疫病猪育种材料,一下子点燃了人们对于基因编辑猪的关注。
此外,相信不少人注意到,这几天“猪3.0”的研究也掀起了热点。9月21日,《自然》旗下的Nature Biomedical Engineering发表了一项来自杭州启函生物的研究成果:科学家们成功地做出了第一代可用于临床的异种器官移植雏形——猪3.0。经过基因编辑技术平台的改造,这种小猪同时满足异种器官移植的两大要求:完全去除猪的内源性逆转录病毒(PERV),与人有着更好的免疫兼容性。
这些生动的案例无一不让我们感受到——基因编辑猪,或将成为下一个研发突破点,将迎来又一波热潮。
基因编辑猪主要在哪些方面实现突破?
从目前的国内外开展的研究来看,基因编辑猪主要是要打造出更健康、更好吃的猪,或者实现其某方面特定性能的增强。
它将在加大肉类生产供应、抵抗病毒耐药性、猪的体温体脂调节、充当疾病模型(辅助研究神经退行性疾病/心血管疾病/癌症/免疫缺陷),以及异种移植应用(器官移植)等方面大放异彩。
肉类生产
猪肉是我国主要的肉类食品来源,提高猪的产肉量和瘦肉率是当前猪育种工作的重要目标。通过基因编辑实现特定功能的增强、抵御常见猪疾,显然有助于猪肉产量的提升。
而猪的体温体脂调节,又有助于生产廋肉猪等品种。2017年,中国科学院动物研究所赵建国带领的团队利用CRISPR技术培育出一批健康的瘦肉猪,脂肪含量比正常猪少24%。赵建国的研究团队将解偶联蛋白1的基因插入到猪的细胞后,发现小猪们体温调节能力明显变强了,脂肪率和膘厚度降低,瘦肉率蹭一下就上来了。
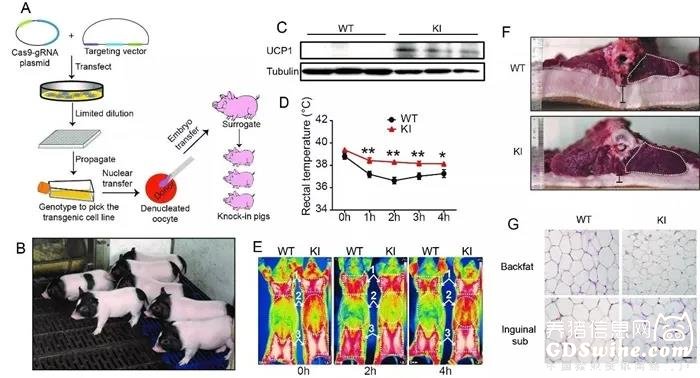
具体来说,科学家们向猪胎儿的成纤维细胞的基因组中内插入一种叫解偶联蛋白1(UCP1)的基因,减少猪脂肪沉积,增加瘦肉率。解偶联蛋白1基因对维持动物的体温和能量平衡起重要作用,激活解偶联蛋白1可以预防饮食引起的肥胖,在动物的冬眠中非常适用。
利用ZFN、TALEN和CRISPR/Cas9等基因组编辑技术制备与培育基因编辑猪,更是猪生产性状遗传育种的一大飞跃。
病毒耐药性
猪繁殖与呼吸综合征病毒(PRRSV)是世界范围内最具经济意义的猪疾病,目前给养猪业造成巨大的经济损失。基因组编辑有助于通过敲除猪体内的病毒受体来建立抗PRRSV猪。
比如,通过常规HR和CRISPR/Cas9分别敲除猪体内潜在的PRRSV进入介质SIGLEC1和CD163。在敲除猪中的PRRSV挑战表明SIGLEC1对感染性没有必要,而CD163是PRRSV的最终受体。CD163敲除猪对PRRSV病毒完全耐药,无明显PRRSV相关症状,血清中未检测到PRRSV抗体和RNA。
近日科学家们获得的全球首例抗三种重大疫病猪育种材料,就使得猪能够抵御猪繁殖与呼吸综合征病毒、猪传染性胃肠炎病毒和猪德尔塔冠状病毒感染,同时还能够保持正常生产性能。
重大传染性疫病是生猪产业的最大威胁。仅2019年,各种传染性疫病造成全球生猪产业经济损失就达数千亿美元。如果能够通过基因编辑技术对这些疾病进行控制和缓解,实现精准删除介导病毒入侵的目的,带来的效益显然是非常可观的。2013年,病毒感染导致近700万头猪死亡。
充当疾病模型
基因组编辑广泛而密集地促进了猪作为人类疾病模型的应用。猪可以比常用的小鼠模型更准确地反映人类疾病的表现。猪疾病模型的合适大小和较长的寿命也有助于开展更接近临床情况的手术操作,以及在临床相关的时间框架内对治疗方法进行长期跟踪和评估。
而利用基因组编辑工具,基因组的变化不仅可以发生在单个基因上,而且可以同时发生在多个基因上,编辑效率很高,从而为模拟和破解类似人类的大型动物模型中复杂的多基因遗传疾病铺平了道路。
比如在神经退行性疾病方面,转基因猪已成功用于建立神经退行性疾病动物模型,包括亨廷顿病(Huntingtons disease,HD)和帕金森病。2018年3月末,利用基因工程技术,中国一组科学家宣布历时4年成功培育出世界首例亨廷顿舞蹈症基因敲入猪。亨廷顿舞蹈病猪可能是一个机会,用来测试CRISPR-Cas9基因编辑是否可以在人类临床应用之前在更大的动物中起作用。
对于世界范围内死亡和残疾的头号“杀手”——心血管疾病治疗,小鼠作为最常用的疾病模型,由于其心脏大小和心率与人类有显著差异,因此通常不能准确地模拟人类心血管系统的生理和病理)。因此,小鼠模型通常无法预测人类的结果。而猪和人的心肌高度相似。因此,猪成为了弥合人类和老鼠之间差距的最具吸引力的模型。
癌症治疗方面,2016年7月据《自然》杂志报道,中国科学家利用CRISPR–Cas9基因编辑技术将修饰后的细胞注入人体进行人类临床试验,这是世界上首个在人类机体中进行的CRISPR试验。今年1月,美国宾夕法尼亚大学肿瘤学教授通过CRISPR基因编辑工具对三名晚期癌症的血细胞进行基因改造,医生从患者血液中提取出免疫系统细胞,对其进行基因改造以帮助患者对抗癌症。之后《连线》刊文称,研究人员今天发表了利用基因编辑技术治疗癌症试验的首份报告。试验结果表明,利用基因编辑技术治疗癌症安全、可行,基因经过编辑的细胞到达预定位置,存活时间长于预期。
器官移植的曙光
为缓解临床移植治疗终末期器官衰竭患者的异体供体日益短缺的问题,家猪是最合适的异种移植供体。猪的心脏、肾、肝等器官与人体器官大小相似,组织学、生理学等特征也相近,因此被很多科学家认为是十分适合提供异种器官的动物。而基因组编辑的进步,使猪的基因修改能够减少跨物种免疫屏障和防止异种移植排斥反应。
这些多基因猪可能表现出进一步的免疫耐受,以减轻异种移植物损伤。
一些新兴的尖端技术,甚至可以在猪体内培养人源化器官(或称为异种生殖)——基因组编辑的使用,极大地促进了这项技术的发展。
近日,杭州启函生物“猪3.0”的研究成果,就是异种器官移植研究的一大典型成果。经过基因编辑技术平台的改造,这种小猪同时满足异种器官移植的两大要求:完全去除猪的内源性逆转录病毒(PERV),与人有着更好的免疫兼容性。
为什么选择猪这种动物进行基因编辑?
猪是生物医学研究中重要的农业资源和动物模型。使用最新开发的基因编辑工具对猪基因组进行高效,精确的修饰,已大大拓宽了猪模型在各个研究领域中的应用。
猪基因组中的修饰,包括敲除和敲入。这些修饰可以赋予猪所需的表型,以改善其生产特性,例如最佳的肉产量、增强的饲料消化率和抗病性。
此外,由于猪在遗传、解剖和生理上与人类相似,因此也可以对猪进行改造以模拟人类疾病或用作异种移植的器官来源以挽救生命。迄今为止,已经通过使用基因编辑工具建立了许多具有农业或生物医学价值的转基因猪模型。这些猪模型有望加快相关领域的研究进展,并使人类受益。
猪在农业和生物医学领域具有广阔的前景。作为重要的肉类来源,家猪提供了全世界最常用的肉类。通过选择育种,人类生产的猪具有农业所需的特征,尽管选择过程漫长而缓慢。
随着基因修饰效率的提高,猪基因组修饰可以赋予任何所需的预定遗传变化,而在传统的选择性育种中要花费数年的时间。许多具有经济意义的特征,例如增加了肉类产量、减少了脂肪沉积、增强了抗病性等。
在生物医学研究中,猪相对于其他模型具有优势,因此可作为重要的大型动物模型。与啮齿动物模型相比,猪在形体/器官大小、寿命、解剖结构、生理学和代谢特征方面与人类具有更高的相似性。
与非人类灵长类动物相比,猪具有低成本和成熟的胚胎操作技术。可以对猪进行修饰以携带人类发现的相同基因突变,以复制遗传性疾病;或在异种移植过程中为器官提供最小的移植排斥。
猪弥合了人类和大量使用的小型啮齿动物模型之间的鸿沟,以支持从基础科学到转化医学的生物医学研究。而当新开发的“基因剪刀”技术问世时,进度更是空前加速。
用于农业的转基因猪通过传统的选育,培育出了一批优良的畜牧品种,生产性能比原有品种显著提高。但是,当生产性状改良到一定程度后,其进一步优化甚至会更加困难,即使是微小的进步也需要更长的育种周期。
基因组编辑,为快速、直接实现家畜遗传改良提供了另一种途径,从而产生通过传统育种无法实现的新型牲畜品种。个体甚至多种性状的完全改善,仅在一代人的时间内就可以完成。
动物基因编辑存在哪些技术难点?
基因编辑技术发展至今已达到一定的高度,在建立动物疾病模型、培育新动物品种和治疗遗传疾病等方面有着巨大潜力。
然而,猪等动物个体性状每年对选择的遗传反应可能比较低下,一些性状如生育能力和抗病性仍然难以改善。另外,由于猪基因学研究的相对滞后和没有功能明确的干细胞可以利用,猪的基因组编辑一直存在效率低、周期长等困难。
此外,基因编辑在降低脱靶率、提高特异性以及效率等方面还有不足。怎样完善基因编辑技术降低其脱靶率、提高特异性、增强其普适性成为当前应解决的问题,是否有更为有效的基因编辑技术还有待进一步研究。
CRISPR/Cas9技术虽然比其他技术更为经济快捷效率高,但在应用于不同对象上时,也应当注意使用不同的方法。比如,在异种器官移植方面它面临的争议就仍然很大,因为猪的基因组携带内源性逆转录病毒,移植到人体后可能有“毒性”;猪器官可能在患者体内引发免疫排斥反应。
总结来看,对于基于基因编辑技术的基因治疗来说,一些关键的技术难点主要是:
1)基因编辑技术,特别是CRISPR技术面世的时间还太短,存在太多不确定的因素,再加上科学家对人类基因功能和调控网络的认知还不足,轻易改动基因可能引发无法预见的安全问题;
2)基因编辑系统导入细胞的效率和基因编辑的效率都还不高,尚无法真正实现临床上的大规模应用;
3)基因编辑系统与病毒载体一样也不具有细胞靶向性。
理论上说,那些长久以来感染的痕迹还可能会对接受了猪器官移植的人类造成伤害,尽管其他研究人员淡化了这种风险。
最后,针对基因编辑猪的更前沿的研究实验将需要一个由外科医生和专家组成的大而熟练的团队,以及源源不断的资金支持。
随着基因组编辑技术的发展与成熟,未来的育种方向将会是对动物进行全基因组设计、改编,创制新品种。但是,转基因、基因组编辑动物的产业化推广还有很漫长的路要走。
走出实验室:一场全球范围的努力
中国组织和全球各国其他组织都正在寻求利用CRISPR来阻止几种经常破坏养猪业的疾病,而且在基因编辑瘦肉猪、探索重大疾病治疗等方面获得了诸多成果。
澳大利亚墨尔本圣文森特医院(St。Vincents Hospital)的异种移植研究带头人彼得·考恩(Peter Cowan)说,中国最近在CRISPR的帮助下重返该领域,这使他们稍微落后于领先的研究小组。“人们只是需要时间来赶上,进入临床前模型,然后获得足够的证据,因为没有人想成为第一个,让它变成一场灾难。”
竞争在加强,不少国家都在发力基因编辑动物实验。一个韩国小组希望将CRISPR基因工程的猪角膜或制造胰岛素的胰岛细胞移植到人类身上,临床试验将于2020年5月开始。
到明年年底,由弗吉尼亚州布莱克斯堡Revivicor领导的美国研究小组,与伯明翰阿拉巴马大学的大卫·库珀合作,可能会在透析患者身上测试带有9个改良基因的猪肾。该团队已经在狒狒身上进行了肾脏测试,但进行人体试验仍需要FDA的批准。库珀说:“现在时间已经很接近了,因为我们已经得到了很多令人鼓舞的数据。”
此前就有德国研究人员在2018年底报告说,他们将经过基因编辑的猪心脏移植到狒狒体内,狒狒接受移植后最长存活时间达6个半月。
2018年1月,美国国立卫生研究院(NIH)宣布,将在6年内提供1.9亿美元资助体细胞基因编辑研究计划。其中包括开发大型动物模型(猪和非人灵长类),以测试新型体内递送系统和基因编辑工具。
2017年,英国科学家通过“基因编辑”技术培育出一种“超级猪”,可抵御对猪来说致命的“蓝耳病”病毒。
中国和国外的研究人员说,全球用CRISPR技术改造动物的工业化努力将很快“走出实验室”,在基础研究、农业和医药领域产生真正的回报。
据麦姆斯咨询的研究报告显示,在治疗应用获得额外增长前,生物技术、农业技术和诊断领域的CRISPR市场规模将从2017年的5.46亿美元,增长到2023年50亿美元。这一增长将主要受到生物技术和农业技术领域的应用推动,其中在生物技术领域,CRISPR将用于预测药物发现的模型,而农业技术领域将利用CRISPR打造创新工具。
仅供参考
- 2022-06-02最高亏损达731元/头,但好消息来了!三季度生猪养殖有望实现
- 2022-04-21好消息!农业农村部:三季度生猪养殖有望实现扭亏为盈
- 2022-04-02专家:7月前后生猪养殖有望止损,年底或盈利
- 2021-07-28李克强:生猪养殖连续严重亏损3个月时,各地可对规模养殖场(户
- 2021-06-28生猪养殖:重视预警 加快调整
- 2021-06-15专家分析价格不会一直下跌!刘永好:生猪养殖户亏损格局还有个过
- 2021-05-17生猪养殖行业历来重视的风向标——猪粮比似乎失效了!
- 2021-05-07中国划分5个大区防控动物疫病,生猪养殖流通格局将调整
- 2020-09-29“今年赚300万元,问题不大。”一位黑猪养殖户这样说
- 2020-09-07四季度供给将开始明显恢复?但未来生猪养殖仍有望保持相对较好收
| 查看所有评论 最新评论 | |
|
|
|
| 发表评论 | |||
|













